報告顯示��,1991年至2020年,美國的癌癥死亡率下降33%����,這主要得益于人們生活方式的改善和癌癥創(chuàng)新療法的持續(xù)開發(fā)�。2022年10月1日至2023年7月31日,美國食品藥品監(jiān)督管理局(FDA)批準了14種新型抗癌療法��、2種新的光學成像劑上市�����,并批準了12種老抗癌療法的新用途���。
日前,美國癌癥研究協(xié)會(AACR)發(fā)布《2023年抗癌進展報告》(AACR Cancer Progress Report 2023���,以下簡稱“報告”)��,回顧了從2022年10月1日到2023年7月31日的重要抗癌進展����。
其顯示�,1991年至2020年,美國的癌癥死亡率下降33%,這主要得益于人們生活方式的改善和癌癥創(chuàng)新療法的持續(xù)開發(fā)�����。據(jù)報告統(tǒng)計���,2022年10月1日至2023年7月31日�����,美國食品藥品監(jiān)督管理局(FDA)批準了14種新型抗癌療法�、2種新的光學成像劑上市����,并批準了12種老抗癌療法的新用途。
盡管如此�,癌癥仍然是一項持續(xù)的全球公共衛(wèi)生挑戰(zhàn)。報告指出�,胰腺癌、子宮癌等癌癥死亡率一直在上升���,人們?nèi)匀恍枰诳拱┑牡缆飞铣掷m(xù)努力�。
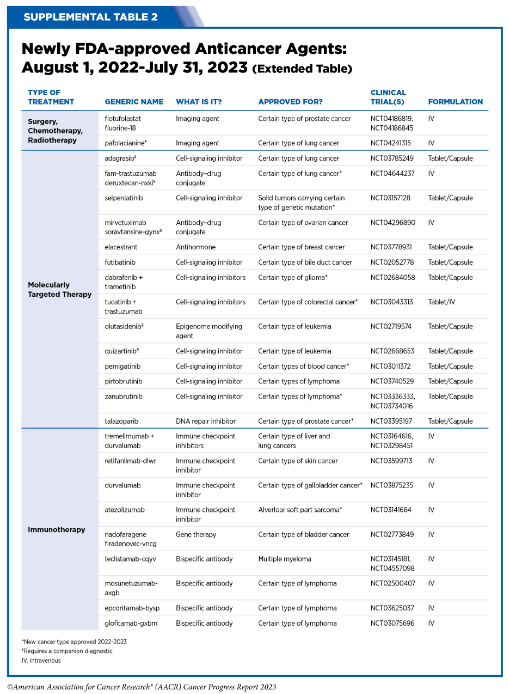
2022年10月1日至2023年7月31日�����,美國食品藥品監(jiān)督管理局(FDA)批準的新型抗癌療法。圖片來源:《2023年抗癌進展報告》
分子靶向療法新進展
如今�����,人們對癌癥生物學的理解已經(jīng)取得了顯著的進步�,科學家已經(jīng)鑒定出許多與腫瘤生長相關的基因突變。報告顯示��,在過去一年獲批的14種新型抗癌療法中���,有7種新型抗癌療法為“分子靶向療法”,它們針對癌癥發(fā)展的特定分子���,更高的精確度使它們比化療藥物更加有效�,且毒性更小�。
例如,一個鉑耐藥卵巢癌抗體-偶聯(lián)(ADC)藥物Mirvetuximab soravtansine-ginx(商品名:Elahere)于2022年11月14日獲FDA加速批準�,用于葉酸受體α(FRα)陽性、鉑耐藥上皮性卵巢癌����、輸卵管癌或原發(fā)性腹膜癌的成年患者��,他們之前接受過1-3種系統(tǒng)性治療方案�,但效果不佳�。Elahere能夠通過特異性識別腫瘤細胞表面的靶標蛋白,釋放藥物分子�,進而實現(xiàn)對腫瘤細胞的精確打擊,被認為有望打開基于生物標志物的卵巢癌治療新時代���。
一項招募了106名FRα陽性���、鉑耐藥卵巢癌患者的III期臨床試驗結果顯示,Elahere對近32%的患者有效�����,中位反應持續(xù)時間為6.9個月�,且有初步證據(jù)表明,Elahere可以提高FRα陽性卵巢癌患者群體的總體生存期�����。
值得一提的是��,杭州華東醫(yī)藥股份有限公司(華東醫(yī)藥����,000963.SZ)于2020年10月引進了Elahere����,交易總金額超過3億美元��,其中包括4000萬美元的首付款和2.65億美元的潛在里程碑付款�。華東醫(yī)藥擁有Elahere在大中華區(qū)(含中國大陸,香港���、澳門和臺灣地區(qū))的獨家臨床開發(fā)及商業(yè)化權益��,其計劃于2023年下半年向中國國家藥品監(jiān)督管理局(NMPA)遞交生物藥上市許可申請(BLA)���。
免疫療法騰飛
“過去十年,癌癥免疫療法已經(jīng)成為令人興奮的癌癥療法之一��?��!眻蟾鎸懙馈0┌Y免疫療法通過激活免疫系統(tǒng)來治療癌癥�����,不同的免疫療法可以通過不同的方式釋放免疫系統(tǒng)能力來對抗癌癥。
免疫檢查點抑制劑(ICIs)通過釋放免疫系統(tǒng)的天然抗癌能力來發(fā)揮作用����,它們可以釋放T細胞的“剎車”,并激活T細胞破壞癌癥細胞��。報告稱�,免疫檢查點抑制劑已經(jīng)徹底改變了癌癥治療的格局。
報告顯示���,過去一年�����,F(xiàn)DA批準了2種新的免疫檢查點抑制劑:Tremelimumab (商品名:Imjudo) 和 Retifanlimab-dlwr(商品名:Zynyz)���。
Imjudo被批準與另一種免疫檢查點抑制劑Durvalumab(商品名:Imfinzi)聯(lián)合使用,以治療不可切除的肝細胞癌(HCC)成年患者����。一項針對既往未接受過全身治療的不可切除HCC患者的隨機III期臨床試驗將Imjudo與Imfinzi聯(lián)合使用的療效與標準護理進行了比較,試驗結果表明����,接受免疫檢查點抑制劑組合的患者在研究過程中死亡的風險降低了22%����。
2023年2月�����,F(xiàn)DA批準Zynyz用于治療轉(zhuǎn)移性或復發(fā)性局部晚期默克爾細胞癌的成年患者����,這是一種罕見的侵襲性皮膚癌。Zynyz是一種靶向程序性死亡受體-1(PD-1)的人源化單克隆抗體����,它通過與PD-1受體結合,提高免疫細胞發(fā)現(xiàn)和殺傷腫瘤細胞的能力��。該批準是基于以下發(fā)現(xiàn):作為II期臨床研究的一部分�����,接受Zynyz治療的患者中���,超過一半的患者的腫瘤縮小。
T細胞結合雙特異性抗體是另一種免疫療法�����,能同時與靶細胞上的腫瘤相關抗原和T細胞上TCR復合體的CD3亞單位結合。據(jù)報告��,過去一年����,美國FDA批準了4款新的T細胞結合雙特異性抗體療法。
2022年10月�,F(xiàn)DA批準Teclistamab cqyv(商品名:Tecvayli)用于多發(fā)性骨髓瘤的成年患者,這些患者在至少接受過4種治療后復發(fā)或從未反應����。Tecvayli能夠靶向結合T細胞表面表達的CD3受體以及多發(fā)性骨髓瘤細胞(MM)和一些健康B細胞表面表達的B細胞成熟抗原(BCMA),將CD3陽性T細胞重新定向到表達BCMA的MM細胞�����,以誘導針對靶細胞的細胞毒作用��。一項I/II期臨床試驗評估了110名患者的免疫治療效果����,結果顯示Tecvayli對超過60%的患者有效。
另外三種獲批的T細胞結合雙特異性抗體療法為Mosunetuzumab-axgb (Lunsumio),Epcoritamab-bysp(Epkinly)�����,和Glofitamab-gxbm (Columvi)���,都通過附著在T細胞上的CD3和CD20發(fā)揮作用���。
嵌合抗原T細胞(CAR-T)療法在癌癥治療中是繞不開的話題,近年來��,它在癌癥醫(yī)學中引起了巨大轟動��。CAR-T療法旨在急劇增加患者具有的癌癥殺傷T細胞的數(shù)量���,從而增強免疫系統(tǒng)尋找和破壞癌細胞的能力��。據(jù)報告介紹���,截至2023年7月31日,F(xiàn)DA已批準6種截然不同的CAR-T細胞療法��,用于治療一系列血液系統(tǒng)癌癥(全球總計有8款CAR-T療法獲批)����。
美國食品藥品監(jiān)督管理局(FDA)批準的CAR-T療法。圖片來源:《2023年抗癌進展報告》
呼吁增加投資和提高臨床試驗參與率
除上述進展外�����,全球還有許多不同類型創(chuàng)新癌癥療法的臨床試驗正在進行中����。報告顯示,截至2022年4月5日�����,全球共有2756項細胞療法臨床試驗正在進行中�,其中包括568款CAR-T療法、73款CAR-NK細胞療法等����,靶向CD19、BCMA�����、TAA和HER2等不同類型靶點��。
盡管癌癥治療已經(jīng)取得了重大進展,但報告強調(diào)�����,目前存在兩個迫切需要克服的挑戰(zhàn):癌癥臨床試驗的參與率低�����,以及參與者缺乏社會人口多樣性����。少數(shù)種族和族裔以及其他醫(yī)療服務不足地區(qū)的人群承擔著與其人數(shù)不成比例的癌癥負擔,但來自這些人群的患者參與新型抗癌療法臨床試驗的比例低得令人失望����。因此必須采用新的方法來告知、教育和鼓勵這些癌癥患者參加臨床試驗��,以便研究人員能夠確定有效的方法來幫助所有患者����。
報告認為,癌癥研究的一個前沿領域是開發(fā)針對頑固性癌癥的療法���,如胰腺癌和膠質(zhì)母細胞瘤��。報告特別關注人類腸道微生物組在調(diào)節(jié)對癌癥治療的反應方面的貢獻�����,以及人類腸道微生物組可能有助于降低患癌癥風險的發(fā)現(xiàn)�,其認為�,這些發(fā)現(xiàn)有可能徹底改變未來的癌癥治療和護理。
癌癥科學和醫(yī)學的新前沿����。圖片來源:《2023年抗癌進展報告》
AACR呼吁增加對癌癥研究的投資?!敖档桶┌Y的死亡率需要癌癥研究人員、政府和癌癥社區(qū)承諾投資癌癥研究���,并增加癌癥患者對臨床試驗的參與����?��!盇ACR主席菲利普·格林伯格(Philip D. Greenberg)說道��。
癌癥的預防同樣重要�����。據(jù)報告估計���,美國40%的癌癥病例是可以預防的�����,預防的方式包括減少使用煙草�、避免不健康的飲食�����、增加身體活動���、降低紫外線輻射暴露���,限制飲酒和預防致病性感染等。
聲明:本文版權歸原作者所有�,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標記有誤�,或侵犯您的版權,請聯(lián)系我們�,我們將在及時修改或刪除內(nèi)容���,聯(lián)系郵箱:marketing@360worldcare.com