工程化T細(xì)胞療法對各種癌癥的治療前景廣闊��,但由于在人體內(nèi)增殖時間短,使得其抗腫瘤功效受限�。例如�,初對CAR-T治療反應(yīng)良好的患者出現(xiàn)癌癥復(fù)發(fā)或進(jìn)展,往往是因為CAR-T細(xì)胞持久性差���。這促使全球科學(xué)家探索提高工程化T細(xì)胞療效的方法�����。
作為CAR-T細(xì)胞療法的關(guān)鍵成分之一��,CD8+T細(xì)胞可以在刺激后持續(xù)自我增殖�����。但另一個關(guān)鍵成分�,CD4+T細(xì)胞則需要反復(fù)的抗原刺激才能繼續(xù)增殖����。
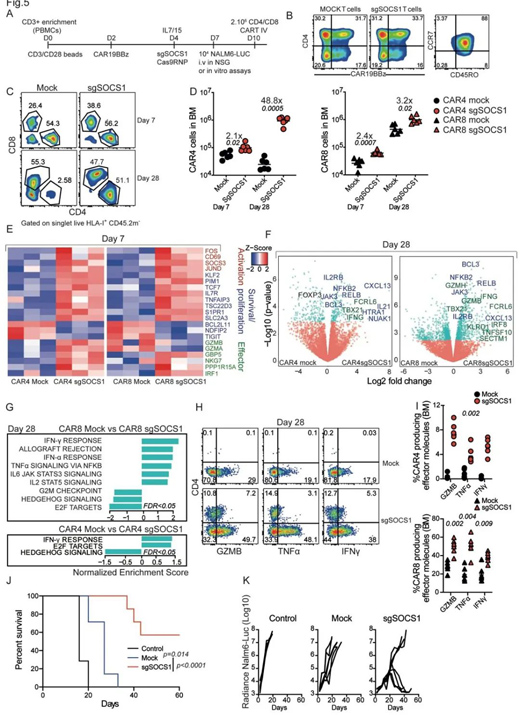
近期,法國居里研究所的科學(xué)家們已經(jīng)發(fā)現(xiàn)了一種潛在的可以用來改善CAR-T療效的機制����。根據(jù)12月3日發(fā)表在Science Immunology上的研究結(jié)果�����,通過對小鼠使用全基因組CRISPR-Cas9篩查����,SOCS1蛋白被確定為抑制CD4+T細(xì)胞擴增和存活的重要“剎車”�。小鼠模型實驗顯示,在人CD19靶向CAR-T細(xì)胞中抑制SOCS1可顯著改善CD4+CAR-T細(xì)胞的持久性和CD8+CAR-T細(xì)胞的功效�。
具體來說,首先為了找到CD4+T細(xì)胞被抑制的機制����,研究人員使用CRISPR篩選來尋找在免疫應(yīng)答期間其失活將恢復(fù)CD4+T細(xì)胞增殖的基因。結(jié)果顯示����,在兩種不同TCR CD4+T細(xì)胞模型中,SOCS1基因失活可恢復(fù)CD4+T細(xì)胞增殖����。進(jìn)一步的分析表明,該基因還可以調(diào)節(jié)免疫系統(tǒng)�����,阻斷幾種信號通路并削弱CD4+T細(xì)胞的增殖。
這一發(fā)現(xiàn)促使研究人員評估SOCS1基因敲除的過繼轉(zhuǎn)移抗癌CD4+T細(xì)胞的直接和間接治療潛力��。他們用CD4+T細(xì)胞治療膀胱癌模型小鼠��,發(fā)現(xiàn)當(dāng)用SOCS1失活的T細(xì)胞對抗腫瘤時��,T細(xì)胞明顯增殖��。并且�,SOCS1缺失的T細(xì)胞浸潤腫瘤的效率比對照細(xì)胞高近十倍�����。
此外��,SOCS1在調(diào)節(jié)CD8+T細(xì)胞方面也發(fā)揮了作用��。在黑色素瘤小鼠模型實驗中����,與對照組相比,接受SOCS1基因敲除的腫瘤特異性CD8+T細(xì)胞的小鼠對腫瘤有顯著且持久的排斥反應(yīng)����。在腫瘤浸潤的SOCS1失活T細(xì)胞中�,研究人員發(fā)現(xiàn)了更多的細(xì)胞毒性分子和效應(yīng)T細(xì)胞�����,這可能解釋了其強大的抗腫瘤作用���。
終末�����,研究人員用人CD4+和CD8+ CAR-T細(xì)胞驗證了他們的發(fā)現(xiàn)�。在淋巴母細(xì)胞白血病小鼠模型實驗中����,接受SOCS1失活CAR-T細(xì)胞治療的小鼠可以更好地控制腫瘤,并且骨髓中累積的CAR-T細(xì)胞數(shù)量比未經(jīng)修飾的CAR-T細(xì)胞高出兩倍��。
SOCS1失活可恢復(fù)體內(nèi)CAR4 T細(xì)胞的擴增�����,并提高CAR8 T細(xì)胞在控制B-ALL疾病方面的功效��。(來源:Science Immunology)
總的來說,這項研究確定SOCS1是一個關(guān)鍵節(jié)點���,在IFN-γ和IL-2信號下游發(fā)揮作用���,抑制CD4+T細(xì)胞增殖、存活和效應(yīng)器功能��。人CAR-T細(xì)胞中SOCS1的失活改善了抗腫瘤反應(yīng)����,表明SOCS1是過繼性T細(xì)胞療法中的主要負(fù)免疫檢查點�����,是優(yōu)化CAR-T細(xì)胞治療的一個有吸引力的靶點���。
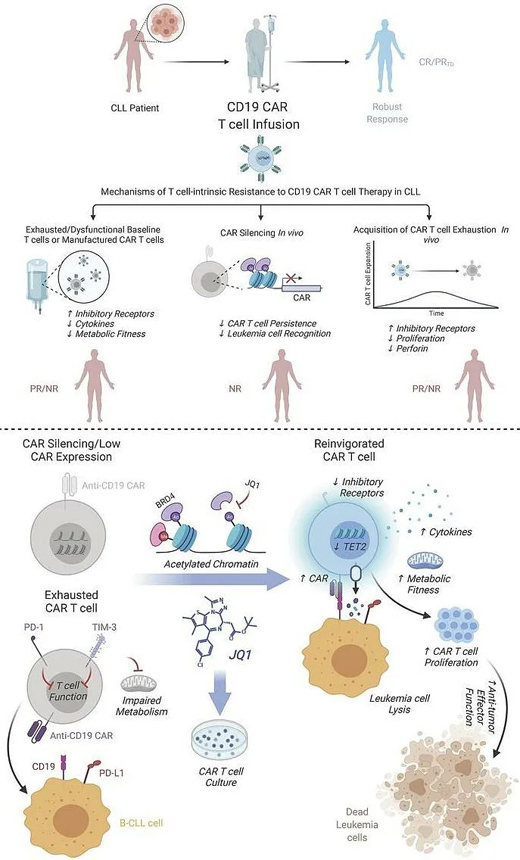
除了該研究成果�,近期在改善CAR-T療效方面還有多項研究突破��。例如���,8月16日發(fā)表于the Journal of Clinical Investigation上的一項由諾華(Novartis)出資支持的賓夕法尼亞大學(xué)的研究��,發(fā)現(xiàn)了一種克服慢性淋巴細(xì)胞白血?���。–LL)CAR-T耐藥性的新方法。
該團隊發(fā)現(xiàn)BET蛋白會降低CAR的表達(dá)���,而利用BET溴結(jié)構(gòu)域抑制劑JQ1來抑制BET��,可以減少T細(xì)胞耗竭�,提高T細(xì)胞在體內(nèi)的擴增能力�。JQ1在未來或可用于CLL患者CAR-T細(xì)胞的工程和擴增。
來源:the Journal of Clinical Investigation
8月24日��,F(xiàn)red Hutchinson癌癥研究中心的研究人員發(fā)表在Science Signaling 上的一篇文章報道����,他們通過借鑒天然T細(xì)胞受體(TCR)設(shè)計了具有更高抗原敏感性的新型CAR。即��,修飾傳統(tǒng)的4-1BB/CD3ζ序列�,嵌入CD3ε或生長因子受體結(jié)合蛋白2(GRB2)結(jié)構(gòu)域以更好地接合CD3ε和LAT,從而產(chǎn)生了具有較低激活抗原閾值和改善抗腫瘤功能的新受體�。
與傳統(tǒng)CAR-T細(xì)胞相比,這種新型的CAR-T細(xì)胞在淋巴瘤�����、白血病和乳腺癌的小鼠模型中顯示出明顯更優(yōu)的抗腫瘤活性。
聲明:本文版權(quán)歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息�,如作者信息標(biāo)記有誤�����,或侵犯您的版權(quán)����,請聯(lián)系我們��,我們將在及時修改或刪除內(nèi)容���,聯(lián)系郵箱:marketing@360worldcare.com